Définition de masse molaire
La grandeur physique qui indique la quantité de matière présente dans un corps se désigne masse. Ce terme, qui vient du latin massa, a pour unité dans le système international le kilogramme (kg).
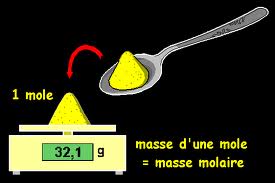
Le concept de masse molaire se rapporte à la masse d’une mole d’une certaine substance en grammes. Rappelons qu’une mole est la quantité de substance qui contient autant d’entités élémentaires (atomes, molécules, ions, etc.) d’un type que d’atomes présentes dans 12 grammes de carbone 12.
La quantité d’unités de base qui indique une mole de substance est donc constante car elle ne dépend pas de la matière ni de la particule. Cette quantité est connue sous le nom de nombre (ou constante) d’Avogadro. Cette constante permet aux chimistes de déterminer le poids des atomes. L’équation montre qu’une mole est égale à 6,022 x 10 ^ 23 particules.
La masse molaire finalement exprime la masse d’une mole en grammes. Si la masse moléculaire d’une substance dans une est p, la masse molaire de cette substance est également p, mais en grammes.
Pour calculer la masse molaire, il faut se rapporter au tableau périodique des éléments. En prenant le cas de l’eau (H2O), on constate qu’une molécule est composée de deux atomes d’hydrogène et d’un atome d’oxygène. La masse atomique de l’hydrogène, en supprimant les décimales, est une u (uma) et celle de l’oxygène, 16 u (uma). En ajoutant les données des deux atomes d’hydrogène et l’atome d’oxygène, on obtient une masse moléculaire de 18 grammes. La masse molaire de l’eau est donc également de 18 grammes.




